본 자료는 Emerging molecular insights into the interaction between probiotics and the host intestinal mucosa. Nat Rev Microbiology. 2012; 10(10): 66–78 의 논문을 한글로 번역, 요약한 자료입니다.
목차
1. 서론
2. 장내 점막
3. 프로바이오틱스의 세포벽 구성성분
3.1 펩타이도글라이칸
3.2 테이코 산
3.3 CPS
3.4 보존된 프로바이오틱스 분자의 균주 특이적인 효과
4. 프로바이오틱스 단백질
4.1 면역조절단백질
4.2 번역 후 변형
5. 프로바이오틱스에 의한 점막 항상성의 조절
5.1 밀착연접(tight junction)의 안정화
5.2 사이토카인의 조절
5.3 In vitro와 동물 모델에서 인간에서의 probiotic 메커니즘으로
6. 사람 개개인의 맥락에서 본 프로바이오틱스
7. 전망
1. 서론
프로바이오틱스는 “적당양의 섭취가 건강에 이득을 주는 살아있는 미생물”을 정의한다. 프로바이토틱스의 가장 보통 형태는 신선한 발효산물이나 건조시킨 세균 보충제이다. 이런것들의 섭취량은 다양한 건강상의 이득과 연관되어 있다 (Box1). 프로바이오틱스의 효과는 특정 집단에게서 잘 확립되어 있어 전반적으로 프로바이오틱스는 면역 무방비 상태 (미성숙 유아기의 괴사성 장염을 막아주는 효과)나 건강이 약화된 특정 사람들(회낭성 항문 문합술(ileal pouch-anal anastomosis) 후의 낭염 경감)에게는 일치하는 이로운 효과를 주었지만 개별적 건강을 향상시키는 효과는 분명하지 않다. 건강이 약화된 사람을 포함하지 않기 위한 정확하게 평가된 바이오마커와 개인의 건강 상태를 측정할 수 있는 의미있는 임상 데이터 판독출력(read-out)이 부족이 건강한 사람에 대한 프로바이오틱스의 예방 가능성 측정을 위한 가장 중요한 도전과제이다. 게다가, 프로바이오틱스 섭취자들의 반응들은 그들의 기본 건강상태에 의존적이기 때문에 프로바이오틱스에 의한 간섭이 면역 조절 효과에 동일한 영향을 주지 않는다.
프로바이오틱 박테리아와 그 반응에 대한 영양유전학적 분석과 장내 존재하는 미생물의 지놈 분석을 통해 숙주 세포의 면역 반응을 조절하는 작용 단백질(effectors)과 그에 상응하는 숙주의 반응과 연관된 기작과 경로를 밝혀내었다. 이를 통해 세가지 프로바이오틱스의 행동 기작이 제시되었다. 1)병원균 박테리아를 경쟁적으로 배제, 2)프로바이오틱스가 밀착연접(tight junction-두 이웃하는 척추 동물 세포들의 세포 막이 밀접하게 연결되어 액체나 특정 화합물이 통과할 수 없는 경계를 형성하는 지역)의 기능을 강화, 3)소장과 같은 숙주의 면역 시스템의 조절. 특히 소장은 인체 면역을 조절하는 중요한 기관이고 생체 내 정상균층(microbiota: 우리 몸에 항상 존재하는 미생물을 합쳐 부르는 말)의 크기가 이 지역에서 상대적으로 작기 때문에 음식에 포함된 미생물의 순간적인 우세 상태(dominance)가 생길 수 있다.
따라서, 이 리뷰에서 우리는 프로바이오틱스가 숙주의 건강에 영향을 줄 수 있는 분자기작에 대해 다루었다. 우리는 프로바이오틱스와의 상호작용에 대한 몇몇 기작적 시각과 연관된 장내 점막 조직의 기능과 구성 요소들에 대해 전반적으로 다뤘고 프로바이오틱스의 물질과 그에 상응하는 숙주의 신호 전달과 반응(건강을 향상시킨다고 알려진)의 계단식 정보 전달에 대해 언급하였다. 이에 더해서 우리는 특정 공생관계에 있는 미생물과의 장내 상호작용과 개인차에 대한 중요성에 대한 시각을 의논하였다. 이러한 시각들은 아마도 프로바이오틱 균주의 다양성 확보와 프로바이오틱스의 개별적인 처방이 이뤄질 수 있도록 유도할 것이다.
2. 장내 점막
영양분의 흡수와 같은 장의 여러 기능들은 선천 면역(innate immunity)과 적응 면역(adaptive immunity)으로 이뤄진 면역 시스템과 통합되어 있다. 장내 점막은 장의 내강(lume)과 상피층 아래 있는 고유층(laminar propria)을 격리하고 있는 상피층(epithelium)을 둘러 쌓고 있다. 따라서 사실상 무균상태의 고유층은 다양한 면역 세포를 가지고 있다. (장내 점막층과 상피층의 세포에 대한 자세한 설명은 그림1의 설명을 참조)
내강의 미생물에 대응하기 위해 상피 세포, 대식세포, 수지상 세포들 간의 상호 작용과 그 작용 결과로 나타나는 T 세포의 분화와 비율은 장내 면역의 항상성을 유지한다. 선천 면역과 적응 면역의 발달과 훈련에 영향을 주는 공생관계의 정상균층(microbiota)에 대한 PRRs (pattern recognition receptors, 패턴 인식 수용체)에 의해 조절된다. PRRs은 프로바이오틱스를 포함한 박테리아의 MAMPs를 인식하는 수용체이며 TLRs(Toll-like receptors), NLRs(NOD-like receptors), CLRs(C-type lectin receptors)이 여기에 해당된다. 장내 항상성은 장세균층 이상(dysbiosis-특정 세균 그룹의 부족이나 과다)에 의해 깨지게 된다. 이러한 장세균층 이상 현상은 종합적인 미생물 대사를 바꾸어 미생물이 생성하는 성분과 인체 면역 시스템의 패턴을 바꾸게 된다. 그 예로 Clostridium 속의 세균의 불균형적인 과다성장은 T 세포에 의해 매개되는 전염증성 면역 반응을 촉진한다. 장세균층이상이란 개념은 유용 미생물의 섭취에 반대되는 인체의 건강 악화를 암시한다. 특정 미생물 공동체의 편향적인 양과 장세균층 이상과의 연관성은 프로바이오틱스의 섭취가 장내 항상성을 회복하고 장세균층 이상을 바로잡아 장내 항상성을 회복할 수 있다는 시각에 의해 보다 좀더 구체화 할 수 있다. 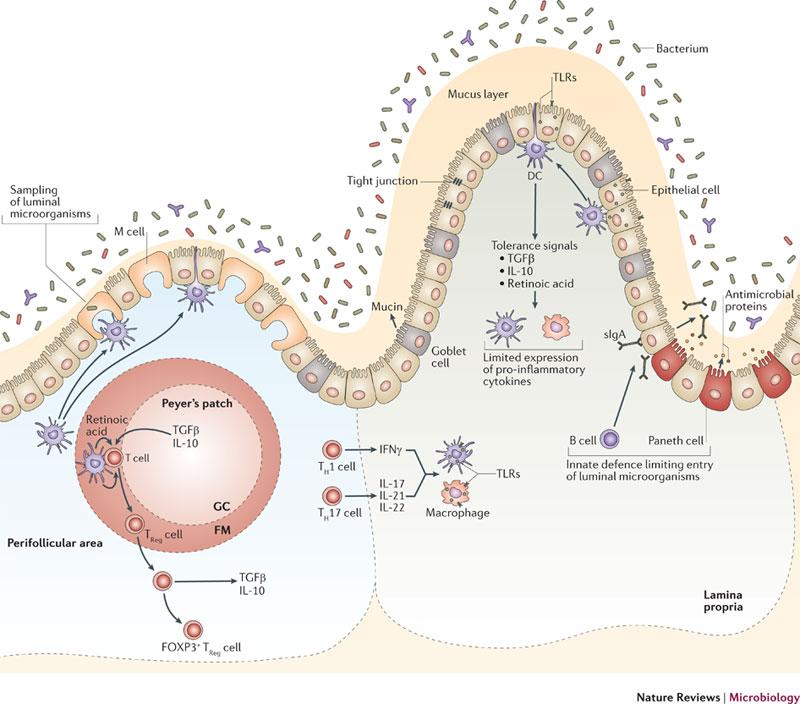
그림1. 장내 미생물에 대한 숙주 방어와 저항성에 대한 기작들
장내 환경은 병원균에 대한 방어작용과 공생 관계의 종에 대한 내성을 통제하는 면역시스템의 세포적 분화를 조절한다. 내성은 많은 요소들 중에서 장내 조직으로의 미생물 침투를 제한하는 선천적 방어 기작에 의존한다. 장내 상피세포들은 내강의 미생물들과 그 아래 있는 장내 조직 사이의 물리적 장벽을 만들어 항상성과 내성을 통제한다. 특화된 상피세포들은 점막층을 만들고(고블릿 세포) 항미생물 단백질들을 분비한다(페네스 세포). B세포들에 생성된 많은 양의 sIgA(secretory immunoglobulin A)는 내강의 미생물에 대한 추가적 방어를 제공한다. 상피세포, 수지상세포(DCs), 대식세포에 의한 선천적인 미생물 감지는 TLRs과 같은 패턴 인식 수용체(PRRs)에 의해 매개된다. 선천면역세포에서 PRRs의 활성화는 미생물의 제거를 매개하는 경로를 유도하고 전염증성 TH1 세포와 TH17 세포들과 적응면역세포들을 활성화시킨다. 그러나 항성과 면역내성을 유지하는 동안에 장내의 대식세포와 수지상세포는 파이어스 패치와 장간 림프절에 있는 T세포에 항원을 제공하고 TReg 세포 집단의 분화를 유도한다. TReg 세포군은 IL-10, TGF, 레티노산에 의해 조절받는다. 장내환경에 있는 상피세포에서 분비된 인자들은 장내 면역세포의 내성에 기여한다.
3. 프로바이오틱스의 세포벽 구성성분
대부분의 상용되는 프로바이오틱스를 차지하고 있는 그람음성 세균의 세포질 막은 두꺼운 세포 벽으로 둘러싸여 있다. 세포벽은 펩티도글라이칸(peptidoglycan), CPS(capsular polysaccharide, 협막 다당), 지질 단백질, 테이코 산(teichonic acid)과 같은 복합층으로 이뤄져 있다. 이러한 물질들의 일부가 숙주의 장내 점막에서 발현하는 특정 PRRs에 의해 인식되는 MAMPs이다.
1) 펩티도글라이칸(peptidoglycan-diaminopimelic acid와 같은 면역 조절 조각들을 포함하는 펜타펩타이드에 의해 교차 결합되어 있는 β 1 4 linked N acetylmuramic acid 와 N acetylglucosamine이 교차하는 cell wall polymer): TLR2와 NLR 단백질인 NLRP1-2(NOD-,LRR- and pyrin domain-containing 1 and 2)와 같은 PRRs은 프로바이오틱스의 다양한 구조의 펩티도글라이칸을 각각 인식하여 면역 반응을 일으킨다. 흥미롭게도, Lactobacillus salivarius str. Ls33가 국소 점막 부위에서 NLRP2에 의존적인 IL-10을 합성하여 쥐에서 화학요법에 의해 유도되는 대장염으로부터 점막을 보호하였지만 뮤로펩타이드(N-acetylmuramic acid(MurNAc)-L-Ala-D-glu-L-Lys60)을 분비하지 않는 Lactobacillus acidophilus str. NCFM에서는 이 효과가 나타나지 않았다. 이는 점막의 NLR 신호 전달에 있어 펩티도글라이칸 성분의 중요성을 보여주고 있을 뿐만 아니라 펩티도글라이칸과 같은 안정된 MAMPs의 다양한 생화학적 특성을 가진 세균의 균주 특이성을 보여주었다.
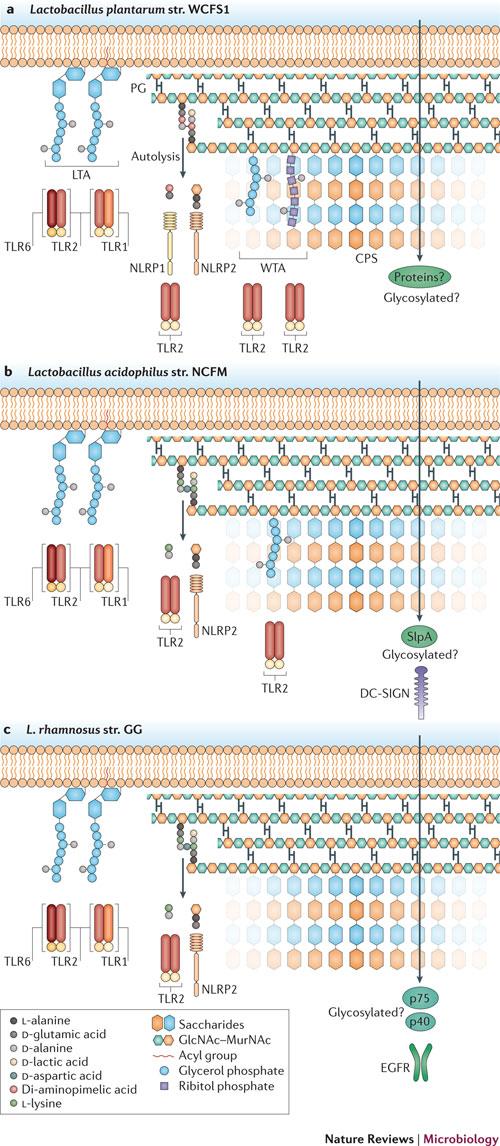
그림2. 세 가지 Lactobacillus 종의 미생물 연관 분자패턴과 그에 상응하는 수용체가 발견되어 있다.
Lactobacillus plantarum str. WCFS1, Lactobacillus acidophilus str. NCFM and Lactobacillus rhamnosus str. GG, 이 세가지 균주들 모두 LTA를 만든다. 이 종들의 LTA는 공통적으로 디아실/트라이아실 글라이코리피드를 포함한다. 이 글라이코리피드들은 heterodimer인 TLR 복합체, TLR2-TR6와 TLR2-RLR1에 의한 신호전달을 유도한다. CPS (capsular polysaccharides)를 인식하는 PRR은 발견되지 않았지만 CPS polymer의 다양한 구성은 이들 probiotics 균주에 대한 다른 수준의 보호작용을 유도할 수도 있다. 펩티도글리칸(PG)에 있는 교차결합된 펜타펩타이드 조각들은 차별적인 신호전달에 기여하는 반면에 WCFS1과 NCFM에 WTA (wall teichoic acid)는 TLR2를 통한 신호전달을 유도한다.
a. The L. plantarum str. WCFS1의 펜타펩타이드는 NLRP1이 인식하는 g-D-glutamine-mesodiaminopimelic acid를 갖는 반면 모든 bacillus에 존재하는 muramic dipeptide는 NLRP2가 인식한다.
b. L. acidophilus의 SlpA(surface layer protein A)는 DC-SIGN이 인식한다.
c. L. rhamnosus str. GG에서 분비된 단백질들(p40, p75)은 EGFR 경로를 통한 신호전달을 유도한다.
2) 테이코 산(teichonic acid-글라이코리피드를 통해 세균의 세포막에 연결되어 있고 D-alanyl과 glycosyl이 교체되어 있는 polyglycerolphosphate polymer): 그람 음성 세균은 phosphodiester 결합으로 펩티도글라이칸의 MurNAc과 공유결합하는 WTA (wall teichonic acid)와 글라이코리피드와 결합하여 세포질 막에 부착되어 있는 LTA (lipoteiconic acid)를 모두 합성한다. 다양한 Lactobacillus세균들에서 정제한 LTA는 TNF(tumor necrosis factor, 종양괴사인자)의 양을 TLR2에 의한 기작을 이용하여 조절하였다. 불행하게도 서로 다른 면역 세포의 사용 (쥐의 대식세포,수지상세포 vs. 인간의 PBMCs (peripheral blood mononuclear cells, 말초혈액단핵세포)과 실험 설계상의 차이들(정제된 LTA의 사용 vs. 살아있는 균주 또는 사균체(heat-killed bacteria)의 사용)로 인해 LTA의 미세한 구조적 변화와 차별적인 면역 반응 간의 명백한 상관관계를 만드는 것은 현재로서는 어렵다. 전반적인 연구 결과들은 LTA의 기본 골격의 변형(modification)이 항염증성 면역 반응 조절을 증가시킨다고 제시하였다.
3) CPS (capsular polysaccharide): 숙주 반응을 조절하는데 있어 CPS의 역할은 균에 따라 반대되는 기능을 보이고 있어 아직 분명하지 않다. 예를 들면 L. casei str. Shirota의 CPS는 대식세포에서 전염증성 반응을 억제하지만 E. Coli str. Nissel 1917의 CPS는 장의 상피세포와 세균의 반응을 촉진한다. 또한, CPS와 같은 글라이칸 구조적 복잡성과 이들의 분석 방법(Glycomics로 알려진)의 어려움으로 인해 CPS의 기능들에 대한 적합한 평가가 어렵다.
4) 보존된 프로바이오틱스 분자의 균주 특이적인 효과(strain-specific effects of conserved probiotic molecules): 프로바이오틱스 효과에 대한 균주 간의 특이성은 현재 거의 알려지지 않았다. 그러나 이 특이성이 세균의 MAMPs의 생화학적 복잡성 및 다양성과 관련이 있다는 것은 의심할 여지가 없다. 게다가 많은 균주들이 환경에 따라 WTA와 CPS의 다수의 변형체들(variants)간의 전환을 하고 있는 것으로 보인다. 그리고 체인 길이의 다양성, 세포 내 위치, 이들 폴리머들간의 상호 작용에 대한효과를 평가하기 위한 노력이 최근에 와서야 시작되어서 이러한 요인들의 구조적 특징을 분석하는 것이 관찰된 균주 특이적인 효과를 설명할 수 있을 것이라고 예상하고 있다.
4. 프로바이오틱스 단백질
정교한 유전학적 기법이 결합된 전체 지놈 서열 및 예상되는 프로테옴의 유용성을 통해 MAMPs의 in silico identification 및 돌연변이 생성(mutagenesis)을 통한 확인 작업이 가능하다. 게다가 여러 종에서 다중 지놈 서열 분석을 통해 균주 특이적인 지놈 영역과 면역조절 성질을 비롯한 표현형 변이와의 연관성을 규명하기 위한 유전체 전체적인 접근을 사용하는 것이 가능하다.
1) 면역조절단백질(immunoregulatory proteins): 흥미롭게도 유산균(lactoba¬cilli)의 SlpA (surface layer protein)는 Lactobacillus helvetivus의 SlpA처럼 장 내 병원균의 경쟁적 배제와 같은 추가적인 역할을 할 수도 있다. L. rhamnosus str. GG의 분비단백질인 p40과 p75는 사이토카인에 의해 유발되는 상피세포의 세포 사멸을 막고, 대장 내에서 TNF에 의해 유발되는 상피세포 손상을 제거하며, 사람과 마우스의 대장 상피세포에서 세포성장을 촉진한다.
박테리오신은 박테리아가 생산하는 항박테리아 단백질 또는 펩타이드를 말한다. 프로바이오틱스 균주가 생산한 박테리오신은 병원체 감염을 피하는 데 중요한 역할을 하는 것으로 보이며, 최근에는 L. salivarius str. UCC118이 만들어낸 antilisterial class Ⅱa 박테리오신이 밝혀진 바 있다. 또한 박테리오신외에 면역 조절에 직접적인 역할을 하는 프로바이오틱스 단백질들이 있다. 특정 plantaricin 유전자(plnI)는 L. plantarum의 위장관 이동 중에 발현되며 WTA와 LTA의 glycosyl 치환하는 teichoic acid glyxodyltransferase를 코딩하는 유전자의 발현 역시 면역조절과 연결되어 있다. L.plantarum str. WCFS1에서 발견한 mannose-specific adhesin을 코딩하는 유전자인 msa는 msa는 장점막에서 숙주의 정균단백질(bacteriocidal protein)인 PAP1(pancreatitis-associated protein 1)의 발현을 유도하여 숙주의 선천성 면역계와 상호작용한다.
2) 번역 후 변형(PTM, post-translational modification): 프로바이오틱스 단백질을 숙주의 DC-SIGN과 같은 특정 PRRs이 인식하는 데 단백질이 아닌 당 부분이 중요한 것으로 보인다.
5. 프로바이오틱스에 의한 점막 항상성의 조절
1) 밀착연접(tight junction)의 안정화: In vitro에서 L. plantarum의 장벽 기능에 미치는 효과는 밀착연접 단백질의 합성을 증가시키거나 TLR2 신호전달에 대응한 밀착연접 단백질 입체구조의 재배열에 따른 밀착연접 기능 강화에도 관련되어 있는 것으로 보인다. 게다가, L. plantarum은 전장염(enterocolitis)과 담도폐쇄 증상이 있는 동물 모델에서 점막의 과투과성을 감소시킨다. PKC (protein kinase C) 관련 신호전달 및 MAPK (mitogen-activated protein kinase) 관련 신호전달 과정을 포함한 상피세포의 장벽 기능 조정, 그리고 사이토카인에 의한 상피세포의 세포사멸과 PI3K (phosphoinositide 3-kinase)-AKT 관련 신호전달과정에 따른 손상 (L. rhamnosus str. GG 에서 분비되는 단백질 p40과 p75에 의한) 등에 대한 생물학적 효과가 새롭게 대체할 수 있는 기작으로 제시되고 있다. 이를 비롯한 여러 연구들에 의해 어떤 프로바이오틱스가 분자 수준에서 상피세포의 장벽 기능에 영향을 줄 것인지 이야기하는 기작에 대한 새로운 시각이 제시되고 있다.
2) 항염증 사이토카인의 조절: 각각의 Lactobacillus 종 및 균주들은 여러 면역 세포에서 놀라울 정도로 각양각색의 사이토카인 반응을 이끌어 낸다. 예를 들어, 여러 L. plantarum 균주에서 유도한 수지상 세포의 배양 상층액에 있는 IL-10 (TH2 세포나 조절 T 세포의 자극과 관련되어 있어서 통상 항염증 효과의 마커로 사용)과 IL-12 (p70 IL-12 heterodimer와 TNF-세포와 NK세포에 의한 IFNγ 생산의 자극 모두와 관련 있는 염증전 반응의 마커로서 사용)의 양은 30~600 배에 이를 만큼 다양하며, 이는 in vitro 상에서 동일 종에서도 균주의 차이에 따라 면역조절 능력이 다이나믹한 수준으로 나타남을 보여주는 전형적인 예가 된다. in vitro 상에서 여러 연구를 통해서, IL-10/IL-12 및 IL-10/TNF의 높은 비율은 trinitrobenzene sulphonic acid으로 유발된 설치류 모델 대장염에 대한 보호효과와 관련이 있으며 in vitro 상에서 IL-10/IL-12의 높은 비율을 끌어내기 위한 프로바이오틱스 균주들을 혼합시키면 마우스의 장간막 림프절에서 조절 T 세포 집단이 증가한다. 몇 가지 성공적인 사례에도 불구하고 in vitro에서의 면역조절 측정 결과를 토대로 in vivo에서 프로바이오틱스의 효과를 예측하는 것은 여전히 어려운 일이다. 중요한 것은, in vitro와 동물 모델 연구간의 상관관계를 더 잘 이해했다고 해도, 사람에서 프로바이오틱스 효과를 이해하고 예측하기 위해서는 이러한 연구들을 추가로 더 변형시켜야 할 것이다.
3) In vitro와 동물 모델에서 인간에서의 probiotic 메커니즘으로: 분자 수준에서 프로바이오틱스에 대응하는 인간 점막의 반응에 관한 연구는 많지 않으며, 이는 임상 수준에서 관찰되는 프로바이오틱스 효과를 설명하는 데 심각한 장애가 되고 있다. 그러나 건강하거나 질병이 있는 자원자를 대상으로 한 최근의 영양유전학적(nutrigenomic) 접근 방법을 동해, 이러한 치료 방법들의 잠재적인 임상 효과와 관련된 프로바이오틱스에 대응하는 인간 점막의 반응을 판독하는 후생유전학적 방법론의 가능성이 보여지고 있으며, 어떤 경우에는 이러한 접근 방법들에 의해 프로바이오틱스에 의한 미지의 임상적 효과가 제시되기도 한다.
예를 들어, L. rhamnosus str. GG의 섭취가 알러지 증상을 막거나 안정시킨다고 알려져 있는데 건강한 자원자에서 L. Rhamnosus str. GG 섭취는 IFN-STAT4 (signal transducer and activator of transcription 4) 축을 통한 TH1 세포 발달을 자극하고, 분비성 단백질 p40과 p75에 대한 반응인 것으로 보이는 세포사멸, 세포 증식, 상피세포 통합을 지연시키는 경로에 중요한 영향을 준다는 것을 확인하였다 (그림3). 마우스 모델 및 in vitro에서 면역 반응의 촉진효과를 보인 여러 L. acidophilus 균주들 중에서 L. acidophius str. Lafti-10 섭취 후에 건강한 사람의 십이지장에서 TH1 유사 반응 중 하나인 IFN과 STAT3-NF-κB 신호전달 조절 경로의 자극하였다. 그러므로 이 경우에 있어서 동물 모델 및 in vitro에서 얻은 발견들은 사람에 대한 연구에서 이들 프로바이오틱스에서 확인된 임상적 효과들을 설명할 수 있다고 추정할 수 있다.
수십 년 전에, in vitro co-culture 모델을 통해 L. plantarum은 사이토카인 IL-12와 TNF 분비를 촉진하는 주요 면역 어쥬번트(adjuvents)로서 확인된 바 있다. 여러 연구 결과들을 통해 L. plantarum의 섭취는 전형적인 면역 자극제에 의한 반응과 유사하게 면역 반응을 이끌어 낼 수 있지만 면역 신호전달의 음성 제어물질들(A20, IκB (inhibitor of NF-κB), SOCS3 (suppressor of cytokine signaling 3) 역시 유도되어 L. plantarum이 점막 면역계의 기민함을 강화하는 반면 면역 항상성은 보존해 준다는 컨셉을 뒷받침한다.
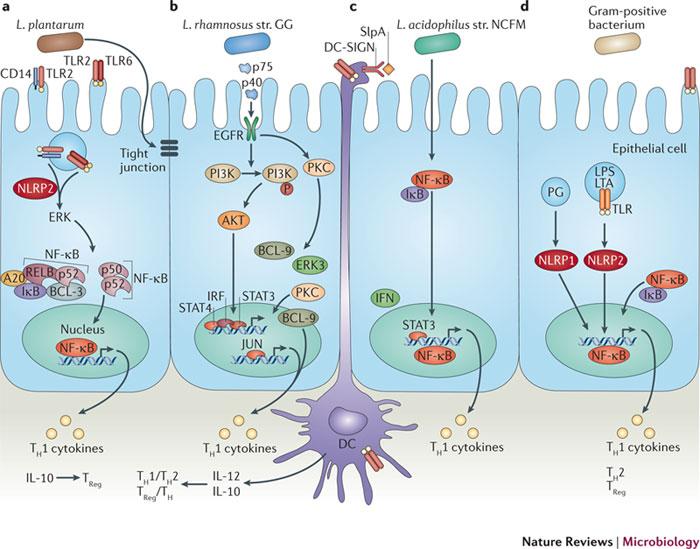
그림 3. 세 가지 유산균 (lactobacilli) 및 그람양성 박테리아의 장내 상피세포 및 수지상 세포들의 프로바이오틱스 분자 상호작용
a. L. plantarum은 NF-κB 신호전달 과정의 조정을 유도한다. 먼저 TLR2-CD14 및 TLR2-TLR6 hetermodimer를 통해 조절되고, 이는 ERK의 NLRP2-의존적 활성화와 NF-kB 활성화를 유도하는 것으로 보인다. 그리고, A20, BCL-3, IκB 등으로 이뤄진 NF-κB 복합체에 의해 TH1-type 사이토카인 방출 및 그에 따른 TReg/TH1 세포 발달에 관여한다.. 게다가 LTA에 의해 밀착연접이 탄탄해지게 된다.
b. L. rhamnosus str. GG가 분비하는 p40과 p75는 세포사멸에 대한 회복력을 조정하고 EGFR의 인산화 및 하위의 PI3K-AKT, PKC 신호전달과정을 유도함으로써 장내 상피세포의 장벽기능을 강화시키게 된다. BCL-9, ERK3, JUN, PARP14는 하위 신호전달 과정에 참여하고 IFN-signal tranducer 및 STAT4 축은 사이토카인 생성을 유도하는 것으로 보인다.
c. L. acidophilus str. NCFM의 LTA와 SlpA는 사이토카인 방출과 TH1 세포 발달을 유도하는데, SlpA는 DC-SIGN에 결합하여 작동한다. L. acidophilus가 IFN-STAT3-NF-kB 신호전달 축을 통해 TH1 사이토카인 생성을 유도함으로써 TH1 세포 발달을 촉진하는 것으로 보인다.
d. 모든 그람양성 박테리아는 숙주세포에 의해 제거될 수 있는(phagocytosed) LTA, 테이코산, 펩티도글리칸 등을 방출하기도 한다. 이 물질들은 NLRP 수용체를 자극하여 NF-κB 하위 신호전달 과정을 유도에 의해 생성되는 사이토카인은 TH1, TH2, TReg 세포의 발달을 촉진한다.
6. 사람 개개인의 맥락에서 본 프로바이오틱스
건강한 자원자의 네 가지 유산균종(L. acidophilus Lafti-L10, L. casei str. CRL-431, L. plantarum str. WCFS1, L. rhamnosus str. GG)에 반응하는 십이지장 트랜스크립톰은 분석 결과는 사람 개개인간의 차이가 프로바이오틱스에 의한 차이보다 10~100배 정도 더 크다는 것이다(그림 4). 따라서 광범위하게 나타나는 개인차는 점막 조직이 건강한 항상성을 유지하기 위해 분자 수준의 ‘건강 대역폭(bandwidth of human health)’의 존재함을 알 수 있다 (그림 5). 그럼에도 불구하고 프로바이오틱스를 섭취는 STAT3 유전자(면역관용과 염증성/항염증성 TH 세포의 핵심적이고 중요한 제어자이며, TH17 세포와 TH2 세포의 발달에 필요)의 조절과 같은 생물학적으로 일관된 전사 수준의 반응을 이끌어낸다. 그러나 개개인이 프로바이오틱스에 의한 간섭에 대해 비슷한 생리적 결과를 경험할 것이라는 것에는 회의적인데, 이는 이 결과가 개인의 분자적 구성에 강하게 의존적이기 때문이다 (그림 4,5). 이 개념은 프로바이오틱스와 다른 식생활 개선 임상 연구에서 공통적으로 관찰되는 무반응자를 설명할 수 있을지도 모르며, 특정(predefined) 증상을 보이는 소집단을 대상으로 하는 맞춤형 영양 컨셉에 프로바이오틱스의 적용이 더 효과적일 것이라고 제안한다. 분자 수준에서 나타나는 점막 조직의 개인차를 설명하는 기본 원리는 설명이 더 필요하며, 숙주의 유전자형이나 생활 습관, 섭식 습관 등 여러 가지 잠재적으로 뒤얽혀 있는 인자들과 장 정상균층의 섭취 등에 영향 받을 것이다.
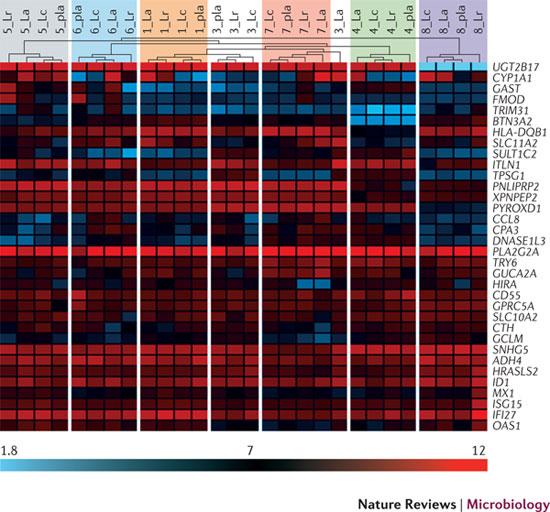
그림 4. 기저 수준의 점막 분자 구성 및 세 가지 probiotic에 대한 반응의 개인별 편차
위의 계통수(dendrogram)는 in vivo에서 세 가지 probiotic에 반응하는 프로파일링 연구에서 가장 다양한 수준으로 발현되는 34가지 점막 유전자의 계층 클러스터링(hierarchical clustering) 결과이다. Heat map은 각 개체에서 이 유전자들의 발현 수준을 낮은 순서에서 높은 순서로, 로그값(log2)으로 보여주고 있다. Unsupervised clustering의 결과인 일곱 개의 클러스터는 각 개인과 일치하지만 프로바이오틱스에 의한 intervention과는 일치하지 않으며, 3_La 프로파일 하나만이 이 클러스터 패턴을 따르지 않는다. 이 결과는 개인차는 프로바이오틱스 섭취에 의한 편차보다 광범위하다는 것을 보여주며, 이는 개인별로 다른 점막 조직의 독자적이고도 안정적인 분자 구성을 의미한다. 흰색 선 사이에 같이 발현되는 유전자 클러스터들을 비교함으로써 유전자 발현이 개인별로 다르다는 것을 알 수 있다.
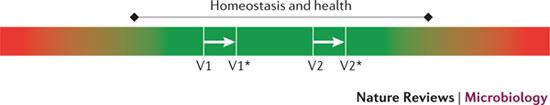
그림5. 분자적 ‘건강 대역폭(bandwidth of human health)’의 개념
이 개념은 건강한 사람 개개인의 점막조직이 차이가 나지만 ‘안정적인’ 분자체 구성에 기초하고 있다. 이것은 건강한 항상성 상태의 그린 존(V1, V2) 안에서 가상적인 개인(virtual individuals)에 의한 두 분자적 위치들의 공간으로 설명할 수 있다. 이러한 분자적 위치들은 프로바이오틱스의 섭취와 같은 식단 조절로 바뀔 수 있다. 프로바이오틱스의 섭취는 공통적으로 보존된 분자적 반응을 끌어내고 또 다른 분자적 위치들(alternative molecular positions, V1*과 V2*)을 유도할 수 있다. 그러나 건강한 개인의 분자적 위치(V1과 V2 사이의 거리)가 프로바이오틱스에 의해 생긴 간섭(intervention, V1과 V1* 사이의 거리와 V2와 V2* 사이의 거리)에 의한 재배치된 위치의 거리를 넘어가게 되기 때문에 모든 개개인이 프로바이오틱스에 의한 간섭이 같은 생리적 결과를 경험할 수 있을지에 대해 명확하지 않다. 결론적으로 프로바이오틱스 효능은 간섭에 의한 조절보다 원래의 건강 대역폭(V1 or V2) 안에서의 분자적 위치에 더 의존적이다.
7. 전망
프로바이오틱스 연구 분야가 숙주와 미생물의 상호작용에 대한 분자과학적으로 진보되어 왔지만 여전히 복잡하고 미세한 차이의 프로바이오틱스의 면역 조절 분자들과 이들의 특성에 대한 분석이 필요하다. 이 물질들이 이끌어내는 숙주의 분자적 생리적 반응과의 관계에 대한 분석을 필요로 한다. 이는 종과 균주 특이성에 대해서도 구체화 할 것이다. 현재까지 몇몇 연구 결과들에서만 단독 생체 내 실험적 셋팅을 통해 다양한 프로바이오틱스 종간이나 균주 간의 비교를 하였기 때문에 종과 균주 특이성에 대해서는 많이 알려지지 않았다. 그러나 다양한 프로바이오틱스를 이용한 연구들은 다른 프로바이오틱에 대한 인체의 반응이 임상과 분자 레벨에서 다양한 반응을 보인다는 것을 뒷받침하였다.
여전히 많은 부분에 대해 이해를 필요로 하는 부분은 생체 내에서 프로바이오틱 세균의 운명이다. 프로바이오틱스 세균들은 위장관의 조건과 숙주가 섭취한 음식을 통해 CPS의 합성, LTA의 치환, 세포 표면 단백질의 합성에 기능하는 유전자들과 미생물의 분자의 합성과 변형에 관련된 균주의 유전자들 발현에 영향을 주어 프로바이오틱스의 균주가 숙주의 신호전달을 조절하고 위장관의 조건에 적응할 수 있다. 그러므로 특정 프로바이오틱스 분자의 분석뿐만 아니라 장관 내에서의 in situ 프로바이오틱 분자 유전자들의 발현에 대한 평가 역시 중요하다.
비록 프로바이오틱스 시장이 여전히 락토바실러스와 비피도박테리움 균주에 많이 우점되어 있지만, 이 상황은 미래에 바뀔지도 모른다. 특히, 인체 장의 정상균층(microbiota)이나 건강하거나 질병 상태의 환경에서 존재하는 특정 미생물 종들이 프로바이오틱스로서 인체에 신중하게 투여될 수 있다. 예를 들면, clostridium 속의 특정 그룹(clusters IV, XIV)이 조절 T 세포를 쥐 결장 점막에 축적시킨다고 하였다. 이러한 세균들은 어린 쥐에게 투여하였을 때 DSS가 유도하는 대장염에 대한 저항성을 가지고 나이든 후에는 시스템 면역글로불린 E 반응(systemic immunoglobulin E responses) 이 감소하였다. 이 결과는 자가면역과 알러지 치료에 있어 이 세균들의 잠재적인 사용 가능성을 뒷받침한다. 인체 장의 metagenomics의 빠르게 진보하는 분야, 특히 장 균주(intestinal isolates)의 지놈 서열 분석과 내장 metagenome libraries의 고속대량 스크리닝을 결합시키는 분야,는 점막 항상성을 향상시키고 유지하는 공생물질의 발견을 도울 것이다.
궁극적으로 이득을 주는 공생 미생물과 프로바이오틱스의 MAMPs가 건강한 사람의 생체 내에서의 행동 모드에 대한 정보와 결합시킨 세밀한 기능 분석은 소비자의 유전자형과 식사습관 정상균층의 장유형(enterotype: 균형이 잘 잡힌 숙주-미생물 공생 상태)의 내용에 따른 성공적인 프로바이오틱스 투여를 위해 필요한 정보를 제공할 것이다.
| 














